| Ohno H, Naito Y, Nakajima H, Tomita M. Construction of a biological tissue model based on a single-cell model: a computer simulation of metabolic heterogeneity in the liver lobule. Artif Life. 2008 Winter;14(1):3-28. Open Access PDF |
細胞内の現象について得られた理解を個体レベルへと敷衍する中間段階として,組織,器官レベルの現象の理解が欠かせない.多くの器官,組織において,部位あるいは時間的に不均質な遺伝子発現調節が知られているが,そうした調節が何のために存在するのかが必ずしも明らかでない事例は少なくない.ほ乳類の肝臓における代謝の多くにも,門脈領域から中心静脈領域にかけて不均質性があることが知られており,metabolic zonation,metabolic heterogeneity などと呼ばれている.肝臓で独占的に行われているアンモニア代謝に関連する酵素の一部にも,こうしたheterogeneity があることが知られている.私たちは,齧歯類の肝細胞におけるアンモニア代謝の数理モデルを作成し,これに基づいて肝小葉モデルを構築した.コンピュータ・シミュレーションの結果は,実際に観察される組織レベルのアンモニア代謝の heterogeneity をよく再現した.この肝小葉モデルでは,組織レベルの代謝を観察しながら,同時に個々の細胞内の代謝を追跡することが可能であり,個々の細胞内での遺伝子レベルの調節が,組織レベル(肝細葉),器官レベル(肝臓)での代謝にどういった意義を持つかについて検討することができる.一部のアンモニア代謝関連酵素にみられる肝小葉内部位特異的な遺伝子発現調節,酵素活性の偏りによって,組織レベル,器官レベルで合理的な利得が生じているのか,またその利得として何が考えられるのかを検討した.
肝臓の組織構造
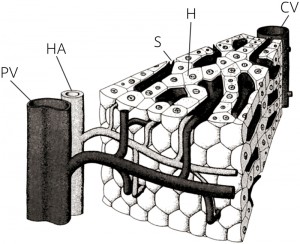 |
| 図1 肝小葉の組織構造:肝小葉への流入血管は,肝動脈の細枝(HA),門脈の細枝(PV)である.これらの血管は肝小葉内に入ると,多孔構造の特殊な毛細血管・類洞(S)に枝分かれし,肝細胞が連なった肝細胞索(H)を通過する.最後には類洞どうしが合流し,肝小葉の中央に位置する中心静脈(CV)から流出する.(Sasse D et.al., 1992) |
肝臓は多数の代謝を同時並行に遂行する「化学工場」である.代謝の対象となる物質は血管を介して肝臓に到達する.肝臓は門脈系という全身の血液循環の中でも特殊な位置に存在する.通常,心臓から拍出された血液は動脈を通って全身に送られ,毛細血管に枝分かれして末梢に分布する.毛細血管は静脈に合流し,心臓に帰っていく.例外的に,毛細血管が合流した後,心臓に戻ることなく別の器官に送られる構造がみられる.これを門脈と呼ぶ.門脈を介した循環では,心臓→動脈→器官1→門脈→器官2→静脈→心臓 の順に血液がめぐることになる.哺乳類の身体にみられる門脈はたった2ヶ所しかない.ひとつは肝臓,もうひとつは脳下垂体である.
肝臓は,消化管に分布した毛細血管が合流した門脈からの血液を受け取る.この構造により,消化器で外界から吸収した物質は,すべて一旦肝臓を通過する.その際,毒物は分解され,過剰な栄養素は肝臓に備蓄される.肝臓は消化吸収した物質に対する「検疫所」の役目を果たしており,肝臓による検疫を通過した物質だけが,全身へと送り届けられる.
これとは別に,肝動脈を介して心臓から直接,酸素を豊富に含む血液も受け取っており,肝臓への流入血管は2系統ある.流出血管は肝静脈1系統だけである.
肝臓は,肝小葉と呼ばれる組織単位の集合である(図1)それぞれの肝小葉に,肝動脈,門脈の細枝から血液が流入し,中心静脈と呼ばれる肝静脈の細枝から流出していく.すべての肝小葉に同じ組成の血液が流入することになるため,等しい代謝を実行できる環境に置かれている.肝臓は肝小葉の並列回路であるといえる.
肝小葉における代謝の不均一性
肝臓を構成する肝小葉が等価である一方,肝小葉内部の代謝は均質ではありえない.なぜなら,肝小葉内には,上流(門脈側)と下流(中心静脈側)があるからである.この上流から下流への流れを porto-central axis(門脈-中心静脈軸)と呼ぶ.上流には,肝細胞による「検疫」を受けていないさまざまな物質が多量に含まれている.これに対し,下流に到達するのは,すでに上流の肝細胞で代謝が進んだ「検疫済み」の血液である.肝細胞にとって,隣接する類洞を流れる血液の組成は「外部環境」である.Porto-central axis 上流の肝細胞と下流の肝細胞では,この「外部環境」の組成が異なるため,同じ代謝を行うことはできない.たとえ上流から下流にかけての肝細胞がまったく等しい遺伝子発現制御を受けたまったく等しい状態の細胞であっても,異なる環境中に置かれるために,細胞内で進行する代謝は同一ではありえない.
そのため,代謝の不均質性(metabolic heterogeneity あるいは metabolic zonation)が必然的に現れる.
あらゆる代謝経路に不均質性がみられるが,本研究では,アンモニア代謝を対象とする.哺乳類では,全身のアンモニア代謝を肝臓が一手に引き受けている.そのため,肝臓のアンモニア代謝から,全身のアンモニア代謝を評価することができる.また,アンモニア代謝による解毒は必須の代謝機構であり,その機能不全は尿毒症などの致死的な状況をもたらす.
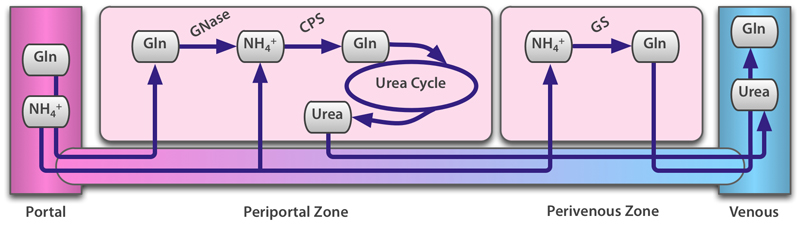
アンモニア代謝の肝内の不均質性について図2にまとめた.上流(門脈側)では尿素回路による尿素賛成が優勢で,下流(中心静脈側)ではグルタミン合成が優勢となっている.この不均質性の要因にはさまざまな議論が戦わされているが,決定的な結論はでていない.
本研究の目的
尿素回路は多量のエネルギーを消費する肝内代謝の中でも,最も多くのエネルギーを消費している代謝経路のひとつである.ラット肝細胞では炭素・窒素源に富んだ培養条件下で,消費される全ATPの約15%が尿素生成に用いられているという報告がある(Schneider W et.al., 1990).著者らは,RNA合成,タンパク質合成に消費されるATPはそれぞれ約4%,13%と報告している.同様に,遺伝子発現調節も数多くの高分子が動員される高度にエネルギーを消費する過程であり,部位特異的遺伝子発現が進化し,metabolic zonation に干渉していることは,何らかの利得(適応度の向上)によって裏付けられると考えられる.ほ乳類のアンモニアの解毒は専ら肝臓で行われるものであるので,肝アンモニア代謝は個体のアンモニア代謝能に直接反映する.本研究において私たちは,数理モデルを用いたシミュレーションにより,「アンモニア代謝にみられる部位特異的遺伝子発現調節は,アンモニア代謝のエネルギー効率の向上に寄与している」という作業仮説を検証した.
肝小葉モデル
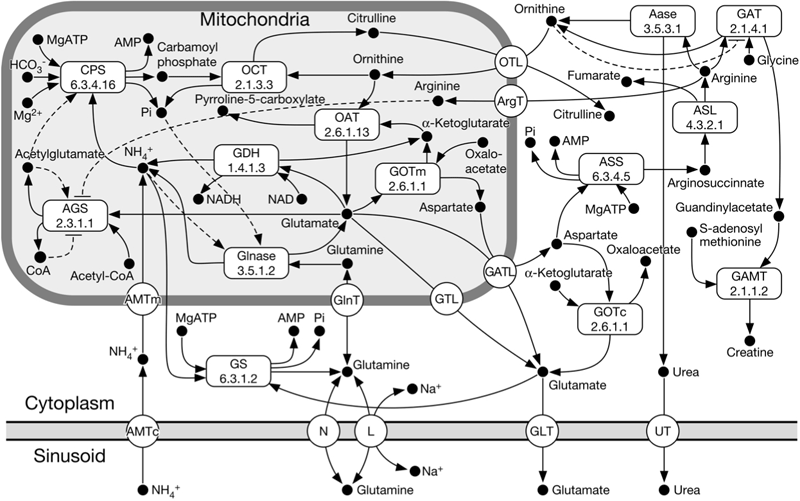
肝臓でのアンモニア代謝の酵素反応速度論モデルを構築した.モデルに含まれる要素とそのネットワークを図3に示した.この肝アンモニア代謝モデルを1つのコンパートメントとし,これを直列に8つ連結して単純な肝細葉モデルを構築した.各コンパートメントは肝実質細胞部分と類洞部分からなる.コンパートメント間の物質の移動は類洞間でのみ生じ,上流から下流に向けて流れる mass action モデルで表現した(肝実質細胞間での物質移動,類洞内での拡散,実質細胞以外の肝細胞機能などは考慮していない).
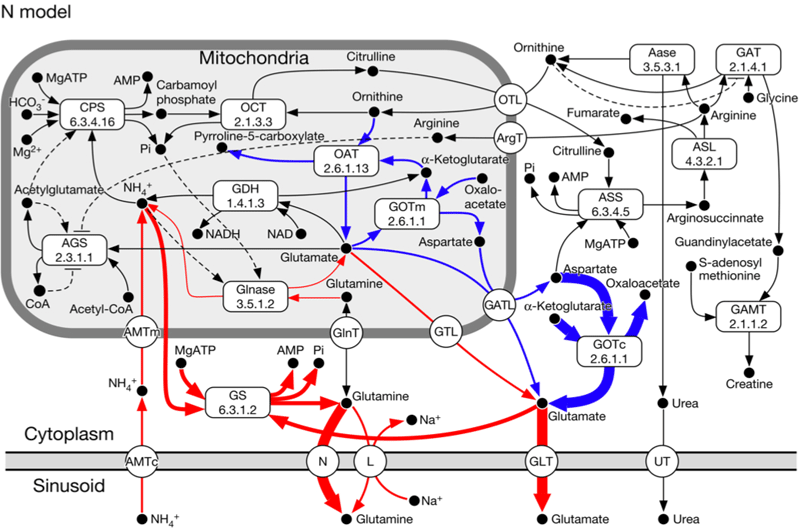
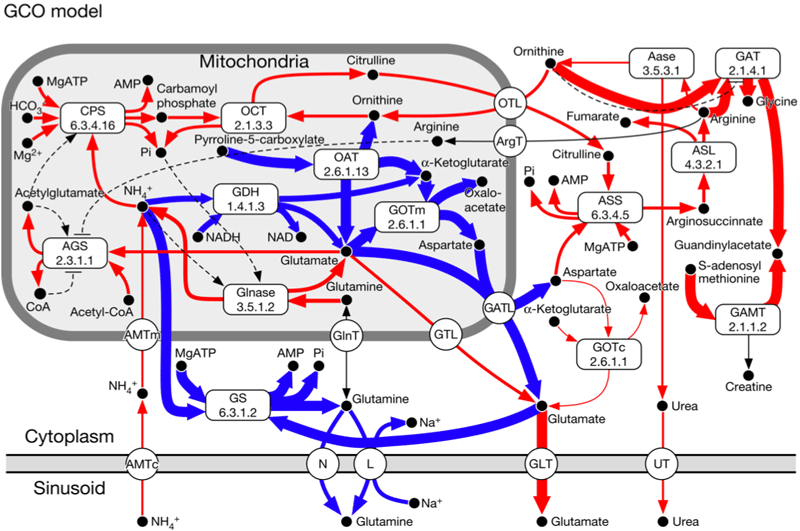
アンモニア代謝関連酵素の局在は Christoffels らのモデルを用いて実装した (Christoffels VM et.al., 1999) .Port-central axisに沿って,CPS, GS, OATに顕著な肝小葉内局在があることが知られており,CPS は門脈周辺領域に優勢,GS は静脈周辺領域に優勢に発現し,OAT は GS と co-localize するとの報告がある (Kuo FC et.al., 1991) .今回は,局在の有無の組み合わせとして,すべての局在を実装した GCO モデルと,局在をまったく含まない N モデルについてシミュレーションを行い,結果を検討した.
Metabolic Zonationの再現結果
遺伝子発現の局在を考慮せず,まったく均質なコンパートメントからなる N モデルでは,門脈周辺領域では GS によるグルタミンへの変換が優勢で,静脈周辺領域ではアスパラギン酸を GOT によってグルタミンに変換する経路が優勢だった.尿素生成に関しては特記すべき差は見られなかった.
一方,GCO モデルでは門脈周辺領域で尿素回路を介した尿素生成が優勢で,静脈周辺領域ではグルタミンの生成が優勢となっており,既知のheterogeneityをよく再現している.
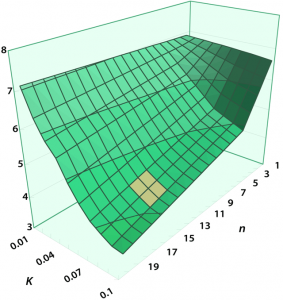 |
| 図4 アンモニア代謝のエネルギー効率の適応度地形:パラメータ n, K を変化させ,各パラメータセットでシミュレーションを実行した.適応度地形図の x, y 軸は n, K の値.z 軸はアンモニア 1 分子を除去するために消費される ATP 分子数(小さいほどエネルギー効率が良い).オレンジ色の領域は,げっ歯類等で観察される,実際の肝小葉内における局在に相当する状態を示す. |
上のシミュレーション結果について,肝細葉全体で,アンモニア 1 分子を除去するために消費される ATP 分子数を算定すると,N モデルでは 7.37 分子,GCO モデルでは 4.21 分子であった.ここから,GS, CPS, OAT の部位特異的遺伝子発現調節によって,アンモニア代謝のエネルギー効率を向上していることが示唆される.アンモニア代謝は肝細胞の ATP 消費量の15%を占めているので,その効率が約 1.8 倍に向上するのであれば,遺伝子発現調節そのものに消費されるエネルギーに十分見合うものだろう(全 RNA,タンパク質合成に使われるATPを合計しても約 17% 程度である).
アンモニア代謝関連酵素の肝小葉内での遺伝子発現の不均質性が,アンモニア代謝のエネルギー効率向上による適応度の向上によって進化したのであれば,その効率はどの程度最適化されているのだろうか.Christoffelsらのモデルで酵素局在を決める主要なパラメータ n, K を変化させ,適応度地形を作成し,検討した(図4).
現在の局在は,この状態空間の中ではエネルギー効率的にはかなり最適化されていることが分かる.各状態におけるアンモニア除去速度を検討すると,現在の状況以上にエネルギー効率の高い点では,それと引き換えにアンモニア除去速度が低下し,適応度が低下することが示唆された.
エネルギー効率と代謝速度,さらに重炭酸イオンの消費などの trade-off によって最適な酵素局在が決まっていると考えられ,今後,さらに検討を要する.
むすび:Singularity との関わり
8区画の単純なモデルで,肝臓のアンモニア代謝の不均質性を概ね再現することができた.
また,現行の遺伝子活性の調節は,エネルギー効率を高める方向に適応していることが示唆された.
肝臓が肝小葉の並列回路として実装されていることは,哺乳類に共通した singularity である.他の〔デザイン〕も可能だったはずなのに,なぜこの〔デザイン〕を選んだのかという問いは singularity の問いである.肝小葉のサイズや,遺伝子発現制御もまた sigularity といえる.
これら,肝臓にみられる階層的組織および制御構造の singularity が deterministic necessity でないことは明らかである.エネルギー効率を高める方向に最適化が進んでいることから,selective bottleneck の作用が示唆されるが,一方で,極限まで最適化することができないとしたら,restrictive bottleneck の拘束を受けていることになる.
さらに議論を進めるためには,肝臓のアンモニア代謝を実行する〔可能デザイン群〕について,より多くの探索を進める必要がある.
References
- Christoffels VM et.al., 1999. A mechanistic model for the development and maintenance of portocentral gradients in gene expression in the liver, Hepatology, 29((4)): 1180-92.
- Kuo FC et.al., 1991. Colocalization in pericentral hepatocytes in adult mice and similarity in developmental expression pattern of ornithine aminotransferase and glutamine synthetase mRNA, Proc Natl Acad Sci U S A, 88((21)): 9468-72.
- Ohno H et.al., 2008. Construction of a biological tissue model based on a single-cell model: a computer simulation of metabolic heterogeneity in the liver lobule, Artif Life, 14((1)): 3-28.
- Sasse D et.al., 1992. Liver architecture, Enzyme, 46((1-3)): 8-32.
- Schneider W et.al., 1990. Balancing of energy-consuming processes of rat hepatocytes, Cell Biochem Funct, 8((4)): 227-32.